الطاقة الذرية هي مصدر الطاقة لكل من المفاعلات النووية والأسلحة النووية، تأتي هذه الطاقة من انشطار أو اندماج الذرات، لفهم مصدر هذه الطاقة، يجب أولاً فهم فيزياء الذرة.
ما هي الذرة؟
الذرة هي أصغر جسيم في عنصر له الخصائص التي تميز هذا العنصر. نمت المعرفة حول طبيعة الذرة ببطء حتى أوائل القرن العشرين.
حقق السير إرنست رذرفورد أحد الإنجازات الأولى في فيزياء الذرة عام 1911. حيث أثبت أن كتلة الذرة تتركز في نواتها. كما اقترح أن النواة لها شحنة موجبة ومحاطة بإلكترونات سالبة الشحنة، والتي تم اكتشافها في عام 1897 من قبل ج. ج. طومسون.
تم استكمال نظرية التركيب الذري هذه بواسطة نيلز بور في عام 1913. وضعت ذرة بور الإلكترونات في أغلفة محددة، أو مستويات كمومية. يستمر فهم الذرة في التركيز على العديد من العلماء
التركيب الذري.
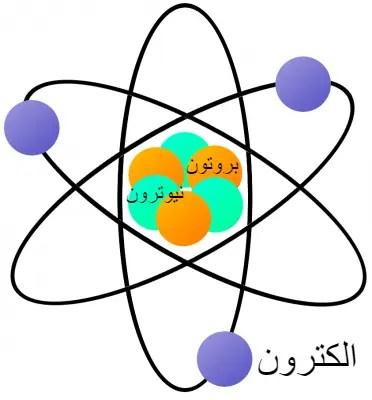
الذرة عبارة عن ترتيب معقد للإلكترونات سالبة الشحنة مرتبة في أغلفة محددة حول نواة موجبة الشحنة. تحتوي هذه النواة على معظم كتلة الذرة وتتكون من البروتونات والنيوترونات (باستثناء الهيدروجين الشائع الذي يحتوي على بروتون واحد فقط).
جميع الذرات لها نفس الحجم تقريبًا. إن وحدة الطول المناسبة لقياس الأحجام الذرية هي أنجستروم (Å)، والتي تعرف بأنها 1 × 10-^10 متر. قطر الذرة حوالي 2-3 Å.
في عام 1897، اكتشف ج. ج. طومسون وجود الإلكترون، مما يمثل بداية الفيزياء الذرية الحديثة. تتبع الإلكترونات سالبة الشحنة نمطًا عشوائيًا داخل أغلفة طاقة محددة حول النواة.
تعتمد معظم خصائص الذرات على عدد وترتيب إلكتروناتها. كتلة الإلكترون 9.1 × 10^-31 كجم. البروتون هو أحد نوعي الجسيمات الموجودين في النواة.
أثبت السير إرنست رذرفورد وجود جسيم موجب الشحنة، بروتون، في النواة في عام 1919. إن شحنة البروتون تساوي الشحنة السالبة للإلكترون ولكنها معاكسة لها. يحدد عدد البروتونات في نواة الذرة نوع العنصر الكيميائي. كتلة البروتون 1.67 × 10-27 كيلوجرامًا.
النيوترون هو النوع الآخر من الجسيمات الموجودة في النواة. اكتشفه الفيزيائي البريطاني السير جيمس تشادويك. لا يحمل النيوترون أي شحنة كهربائية وله نفس كتلة البروتون.
مع نقص الشحنة الكهربائية، لا يتم صد النيوترون بواسطة سحابة الإلكترونات أو النواة، مما يجعله أداة مفيدة للتحقق من بنية الذرة.
حتى البروتونات والنيوترونات الفردية لها بنية داخلية تسمى الكواركات. توجد ستة أنواع من الكواركات. لا يمكن تحرير هذه الجسيمات دون الذرية ودراستها بمعزل عن غيرها. يستمر البحث الحالي في بنية الذرة.
النظائر الذرية.
في فيزياء الذرة السمة الرئيسية للذرة هي عددها الذري، والذي يعرف بعدد البروتونات. يتم تحديد الخصائص الكيميائية للذرة من خلال عددها الذري ويُشار إليها بالرمز Z.
العدد الإجمالي للنكليونات (البروتونات والنيوترونات) في الذرة هو رقم الكتلة الذرية. يُشار إلى هذه القيمة بالرمز A. يُشار إلى عدد النيوترونات في الذرة بالرمز N.
وبالتالي فإن كتلة الذرة هي A = N + Z. وتسمى الذرات التي لها نفس العدد الذري ولكن مع كتل ذرية مختلفة نظائر.
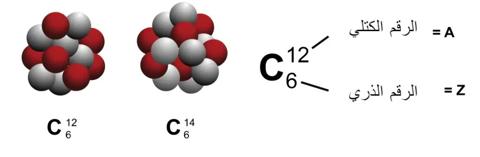
النظائر لها خصائص كيميائية متطابقة، ولكن لها خصائص نووية مختلفة للغاية. على سبيل المثال، هناك ثلاثة نظائر للهيدروجين. اثنان من هذه النظائر مستقرة (غير مشعة)، لكن التريتيوم (بروتون واحد ونيوترونان) غير مستقر.
معظم العناصر لها نظائر مستقرة. يمكن أيضًا إنشاء النظائر المشعة للعديد من العناصر.
إقرأ أيضاً… ما هي أشكال الطاقة؟ مع أمثلة عليها.
معادلة أينشتاين: E = mc2.
كتلة النواة أصغر بنحو 1٪ من كتلة البروتونات والنيوترونات الفردية. هذا الاختلاف يسمى عيب الكتلة. ينشأ عيب الكتلة من الطاقة المنبعثة عندما ترتبط النيوكليونات (البروتونات والنيوترونات) معًا لتشكل النواة.
هذه الطاقة تسمى طاقة الربط. تحدد طاقة الارتباط أي النوى مستقرة وكمية الطاقة التي يتم إطلاقها في تفاعل نووي. النوى الثقيلة جدًا والنوى الخفيفة جدًا لها طاقات ارتباط منخفضة.
هذا يعني أن النواة الثقيلة ستطلق الطاقة عندما تنقسم (الانشطار)، وسوف تطلق نواتان خفيفتان الطاقة عند انضمامهما (الاندماج). نواة الهيدروجين 2، على سبيل المثال، تتكون من بروتون واحد ونيوترون واحد، يمكن فصلها تمامًا عن طريق توفير 2.23 مليون إلكترون فولت (MeV) من الطاقة.
على العكس من ذلك، عندما يتحد نيوترون وبروتون يتحركان ببطء لتشكيل نواة هيدروجين 2، يتم تحرير 2.23 ميغا إلكترون فولت.
يرتبط عيب الكتلة والطاقة الملزمة بصيغة ألبرت أينشتاين، E = mc2. في عام 1905، طور أينشتاين نظرية النسبية الخاصة. كان أحد الآثار المترتبة على هذه النظرية هو أن المادة والطاقة قابلة للتبادل مع بعضهما البعض.
تنص هذه المعادلة على أن الكتلة (م) يمكن تحويلها إلى كمية من الطاقة (E)، حيث c هي سرعة الضوء. نظرًا لأن سرعة الضوء عدد كبير، وبالتالي فإن c تربيع ضخمة، يمكن تحويل كمية صغيرة من المادة إلى كمية هائلة من الطاقة.
هذه المعادلة في فيزياء الذرة هي مفتاح قوة الأسلحة النووية والمفاعلات النووية.
الاضمحلال الإشعاعي.
النشاط الإشعاعي هو التفكك التلقائي للنواة الذرية. تم الإبلاغ عن هذه الظاهرة لأول مرة في عام 1896 من قبل الفيزيائي الفرنسي هنري بيكريل.
ساهمت ماري كوري وزوجها بيير كوري في فهم النشاط الإشعاعي. أدى بحثهم إلى اكتشاف عنصرين مشعين جديدين، البولونيوم والراديوم، وأجبروا العلماء على تغيير أفكارهم حول بنية الذرة.
النشاط الإشعاعي هو نتيجة محاولة ذرة الوصول إلى تكوين نووي أكثر استقرارًا. يمكن تحقيق عملية التحلل الإشعاعي من خلال ثلاث طرق أولية؛ يمكن للنواة تغيير أحد نيوتروناتها إلى بروتون مع الانبعاث المتزامن للإلكترون (اضمحلال بيتا)، عن طريق إصدار نواة الهيليوم (تحلل ألفا)، أو عن طريق الانشطار التلقائي (الانقسام) إلى جزأين.
غالبًا ما يرتبط بهذه الأحداث إطلاق فوتونات عالية الطاقة أو أشعة جاما. هناك طريقة أخرى للتحلل الإشعاعي، لكنها أكثر غرابة في طبيعتها.
كل مادة مشعة فردية لها فترة اضمحلال مميزة أو نصف عمر. نصف العمر هو الفترة الزمنية اللازمة حتى يتحلل نصف النوى الذرية لعينة مشعة.
النظير المشع الكوبالت 60، المستخدم في العلاج الإشعاعي للسرطان، له، على سبيل المثال، نصف عمر يبلغ 5.26 سنة. وهكذا، بعد هذه الفترة الزمنية، فإن العينة التي تحتوي في الأصل على 16 جرامًا من الكوبالت 60 تحتوي فقط على 8 جرام من الكوبالت 60 وستصدر نصف كمية الإشعاع فقط.
بعد فاصل زمني آخر قدره 5.26 سنة، ستحتوي العينة على 4 جرامات فقط من الكوبالت 60. يمكن أن تتراوح فترات نصف العمر من آلاف السنين إلى ميلي ثانية.
في بعض الأحيان، بعد الخضوع للاضمحلال الإشعاعي، تظل الذرة الجديدة في صورة مشعة. وهذا يعني أن الذرة سوف تتحلل مرة أخرى وهي تحاول الوصول إلى حالة نووية مستقرة.
إقرأ أيضاً… ما هي الطاقة المشعة؟
اضمحلال ألفا.
في اضمحلال ألفا، ينبعث جسيم موجب الشحنة، مطابق لنواة الهليوم 4، تلقائيًا. يتكون هذا الجسيم، المعروف أيضًا باسم جسيم ألفا، من بروتونين واثنين من النيوترونين. تم اكتشافه وتسميته من قبل السير إرنست رذرفورد في عام 1899.
يحدث تحلل ألفا عادة في النوى الثقيلة مثل اليورانيوم أو البلوتونيوم، وبالتالي فهو جزء كبير من التداعيات الإشعاعية الناتجة عن انفجار نووي.
نظرًا لأن جسيم ألفا أكبر نسبيًا من الأشكال الأخرى للانحلال الإشعاعي، فيمكن إيقافه بواسطة ورقة ولا يمكنه اختراق جلد الإنسان. يمكن لجسيم ألفا 4 MeV أن ينتقل حوالي 1 بوصة عبر الهواء.
على الرغم من أن نطاق جسيم ألفا قصير، إذا تم ابتلاع عنصر تحلل ألفا، يمكن لجسيم ألفا أن يلحق ضررًا كبيرًا بالأنسجة المحيطة. هذا هو السبب في أن البلوتونيوم، ذو نصف عمر طويل، خطير للغاية إذا تم تناوله.
اضمحلال بيتا.
تطلق الذرات جسيمات بيتا من خلال عملية تعرف باسم تحلل بيتا. يحدث تحلل بيتا عندما تحتوي الذرة على عدد كبير جدًا من البروتونات أو عددًا كبيرًا جدًا من النيوترونات في نواتها.
يمكن أن يحدث نوعان من تحلل بيتا. نوع واحد (اضمحلال بيتا الإيجابي) يطلق جسيم بيتا موجب الشحنة يسمى البوزيترون والنيوترينو. النوع الآخر (اضمحلال بيتا السالب) يطلق جسيم بيتا سالب الشحنة يسمى الإلكترون ومضاد النيترينو.
النيوترينو ومضاد النوترينو عبارة عن جسيمات أولية عالية الطاقة ذات كتلة قليلة أو معدومة ويتم إطلاقها من أجل الحفاظ على الطاقة أثناء عملية الاضمحلال. يعتبر اضمحلال بيتا السلبي أكثر شيوعًا من اضمحلال بيتا الإيجابي.
اكتشف السير إرنست رذرفورد هذا الشكل من التحلل الإشعاعي في عام 1899، على الرغم من عدم ملاحظة النيوترينو حتى الستينيات. بعدها تطور علم فيزياء الذرة.
تمتلك جسيمات بيتا جميع خصائص الإلكترونات. في وقت انبعاثهم، يسافرون بسرعة الضوء تقريبًا. سوف ينتقل جسيم 0.5 ميغا إلكترون فولت نموذجي حوالي 3 أمتار عبر الهواء، ويمكن إيقافه بمقدار 5 سم من الخشب.
أشعة جاما.
أشعة جاما هي نوع من الإشعاع الكهرومغناطيسي ينتج عن إعادة توزيع الشحنة الكهربائية داخل النواة. كما أن أشعة جاما هي في الأساس أشعة سينية نشطة للغاية؛ لا يعتمد التمييز بين الاثنين على طبيعتهما الجوهرية بل على أصولهما.
تنبعث الأشعة السينية أثناء العمليات الذرية التي تنطوي على إلكترونات نشطة. ينبعث إشعاع جاما من نوى مثارة أو عمليات أخرى تتضمن جسيمات دون ذرية؛ غالبًا ما يصاحب إشعاع ألفا أو بيتا، حيث قد تترك النواة التي تنبعث منها هذه الجسيمات في حالة مثارة (طاقة أعلى).
أشعة جاما أكثر اختراقًا من إشعاع ألفا أو بيتا، ولكنها أقل تأينًا. من المحتمل أن تسبب أشعة جاما الناتجة عن الغبار النووي أكبر عدد من الضحايا في حالة استخدام الأسلحة النووية في حرب نووية.
تسبب أضرارًا مشابهة لتلك التي تسببها الأشعة السينية مثل الحروق والسرطان والطفرات الجينية.
إقرأ أيضاً… ما هي الأشعة تحت الحمراء؟ وما هي خصائصها؟
الانشطار التلقائي.
نوع آخر من الاضمحلال الإشعاعي هو الانشطار التلقائي. في عملية الاضمحلال هذه، تنقسم النواة إلى جزأين متساويين تقريبًا وعدة نيوترونات حرة. كما يتم أيضًا إطلاق كمية كبيرة من الطاقة.
لا تتحلل معظم العناصر بهذه الطريقة ما لم يكن عدد كتلتها أكبر من 230. يمكن للنيوترونات الضالة التي يطلقها الانشطار التلقائي أن تبدأ تفاعلًا متسلسلًا قبل الأوان. هذا يعني أن وقت التجميع للوصول إلى كتلة حرجة يجب أن يكون أقل من معدل الانشطار التلقائي.
يتعين على علماء فيزياء الذرة النظر في معدل الانشطار التلقائي لكل مادة عند تصميم الأسلحة النووية. على سبيل المثال، معدل الانشطار العفوي للبلوتونيوم 239 أكبر بحوالي 300 مرة من معدل اليورانيوم 235.
أجبر هذا العلماء العاملين في مشروع مانهاتن على التخلي عن العمل على تصميم من نوع بندقية يستخدم البلوتونيوم.