يحتوي نموذج بور للذرة على ذرة تتكون من نواة صغيرة موجبة الشحنة تدور حول إلكترونات سالبة الشحنة. فيما يلي نظرة فاحصة على نموذج بور، والذي يُسمى أحيانًا نموذج رذرفورد-بور.
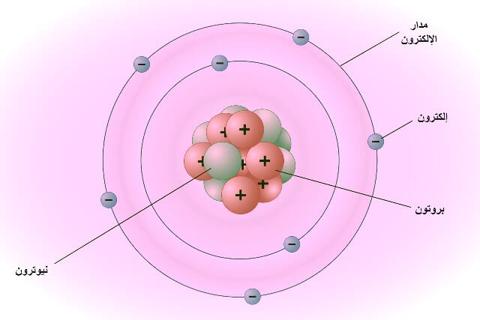
نظرة عامة على نموذج بور للذرة.
اقترح نيلز بور نموذج بور للذرة في عام 1915. ولأن نموذج بور هو تعديل لنموذج رذرفورد السابق، أطلق بعض الناس على نموذج بور نموذج رذرفورد-بور.
يعتمد النموذج الحديث للذرة على ميكانيكا الكم. يحتوي نموذج بور على بعض الأخطاء، لكنه مهم لأنه يصف معظم الميزات المقبولة للنظرية الذرية بدون كل الرياضيات عالية المستوى للنسخة الحديثة.
على عكس النماذج السابقة، يشرح نموذج بور صيغة رايدربيرج لخطوط الانبعاث الطيفي للهيدروجين الذري.
نموذج بور هو نموذج كوكبي تدور فيه الإلكترونات سالبة الشحنة حول نواة صغيرة موجبة الشحنة تشبه الكواكب التي تدور حول الشمس (باستثناء أن المدارات ليست مستوية).
تشبه قوة جاذبية النظام الشمسي رياضياً قوة كولوم (الكهربائية) بين النواة الموجبة الشحنة والإلكترونات سالبة الشحنة.
الأفكار الرئيسية لنموذج بور.
- تدور الإلكترونات حول النواة في مدارات لها حجم وطاقة محددان.
- ترتبط طاقة المدار بحجمه. تم العثور على أدنى طاقة في أصغر مدار.
- يُمتص الإشعاع أو ينبعث عندما ينتقل الإلكترون من مدار إلى آخر.
نموذج بور للهيدروجين.
أبسط مثال على نموذج بور هو ذرة الهيدروجين (Z = 1) أو أيون شبيه بالهيدروجين (Z> 1)، حيث يدور إلكترون سالب الشحنة حول نواة صغيرة موجبة الشحنة.
سيتم امتصاص الطاقة الكهرومغناطيسية أو انبعاثها إذا تحرك الإلكترون من مدار إلى آخر. كما يسمح فقط بمدارات إلكترونية معينة.
يزداد نصف قطر المدارات المحتملة إلى n2، حيث n هو الرقم الكمي الرئيسي. ينتج الانتقال 3 → 2 السطر الأول من سلسلة بالمر. بالنسبة للهيدروجين (Z = 1) ينتج عن ذلك فوتون له طول موجي 656 نانومتر (ضوء أحمر).
إقرأ أيضاً… مقدمة في فيزياء الذرة.
نموذج بور للذرات الأثقل.
تحتوي الذرات الأثقل على عدد من البروتونات في النواة أكثر من ذرة الهيدروجين. مطلوب المزيد من الإلكترونات لإلغاء الشحنة الموجبة لجميع هذه البروتونات.
يعتقد بور أن كل مدار إلكترون يمكن أن يحمل فقط عددًا محددًا من الإلكترونات. بمجرد امتلاء المستوى، سترتفع الإلكترونات الإضافية إلى المستوى التالي. وهكذا، وصف نموذج بوهر للذرات الأثقل قذائف الإلكترون.
شرح النموذج بعض الخصائص الذرية للذرات الأثقل ، والتي لم يتم إنتاجها من قبل. على سبيل المثال، أوضح نموذج الغلاف لماذا أصبحت الذرات أصغر تتحرك عبر فترة (صف) من الجدول الدوري، على الرغم من احتوائها على عدد أكبر من البروتونات والإلكترونات.
كما أوضح سبب خمول الغازات النبيلة ولماذا تجذب الذرات الموجودة على الجانب الأيسر من الجدول الدوري الإلكترونات، بينما تفقدها الذرات الموجودة على الجانب الأيمن.
ومع ذلك، افترض النموذج أن الإلكترونات الموجودة في المدارات لا تتفاعل مع بعضها البعض ولا يمكنها تفسير سبب تكدس الإلكترونات بطريقة غير منتظمة.
مشاكل مع نموذج بور.
يمتلك نموذج بور للذرة بعض المشاكل، وهي تشمل:
- إنه ينتهك مبدأ عدم اليقين لهاينزبيرج لأنه يعتبر أن للإلكترونات نصف قطر ومدار معروفين.
- يوفر نموذج بوهر قيمة غير صحيحة للزخم الزاوي المداري للحالة الأرضية.
- يقدم تنبؤات سيئة فيما يتعلق بأطياف الذرات الأكبر.
- لا يتنبأ بالشدة النسبية للخطوط الطيفية.
- لا يشرح نموذج بوهر البنية الدقيقة والبنية فائقة الدقة في الخطوط الطيفية.
- لا يفسر تأثير زيمان.
إقرأ أيضاً… 10 نظريات فيزيائية غريبة، لكنها مذهلة!
التحسينات على نموذج بور.
كان أبرز صقل لنموذج بور هو نموذج سومرفيلد، والذي يُطلق عليه أحيانًا نموذج بور-سومرفيلد. كما أنه في هذا النموذج، تسافر الإلكترونات في مدارات إهليلجية حول النواة بدلاً من مدارات دائرية.
كان نموذج سومرفيلد أفضل في شرح التأثيرات الطيفية الذرية، مثل تأثير ستارك في تقسيم الخط الطيفي. ومع ذلك، لم يستطع النموذج استيعاب رقم الكم المغناطيسي.
في النهاية، تم استبدال نموذج بور والنماذج القائمة عليه بنموذج Wolfgang Pauli المستند إلى ميكانيكا الكم في عام 1925.
تم تحسين هذا النموذج لإنتاج النموذج الحديث، الذي قدمه اروين شرودينغر في عام 1926. واليوم، يتم شرح سلوك ذرة الهيدروجين باستخدام ميكانيكا الموجة لوصف المدارات الذرية.