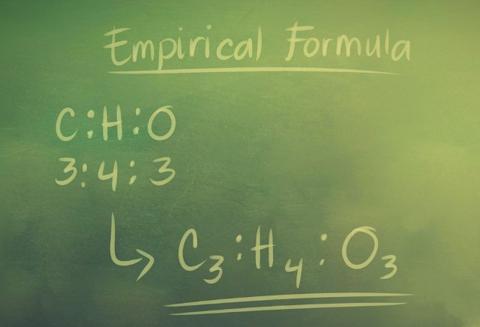يتم تعريف الصيغة التجريبية (Empirical Formula) للمُركبّات في الكيمياء على أنها “الصيغة التي توضح نسبة العناصر الموجودة في المركب، ولكن ليس الأعداد الفعلية للذرات الموجودة في الجزيء.”
يتم الإشارة إلى النسب بواسطة رموز بجانب رموز العناصر. تُعرف الصيغة التجريبية أيضًا باسم أبسط صيغة لأن الأحرف المنخفضة هي أصغر عدد صحيح يشير إلى نسبة العناصر.
الصيغة التجريبية في الكيمياء.
تُعرف الصيغة التجريبية (Empirical Formula) أيضًا بأنها أبسط صيغة في الكيمياء. إنها تعطي أصغر نسبة عدد صحيح للعناصر في مركب باستخدام الرموز السفلية التالية لرموز العناصر.
في بعض الحالات، تكون الصيغة التجريبية هي نفس الصيغة الجزيئية (Molecular Formula)، والتي تعطي العدد الفعلي للذرات في المركب (على سبيل المثال، H2O).
خلاف ذلك، فإن الصيغة الجزيئية هي مضاعف الصيغة التجريبية (على سبيل المثال، CH2O هي الصيغة التجريبية للجلوكوز، C6H12O6).
أمثلة على الصيغة التجريبية.
يحتوي الجلوكوز على الصيغة الجزيئية لـ C6H12O6. يحتوي على 2 مول من الهيدروجين لكل مول من الكربون والأكسجين. الصيغة التجريبية للجلوكوز هي CH2O.
الصيغة الجزيئية للريبوز هي C5H10O5، والتي يمكن اختزالها إلى الصيغة التجريبية CH2O.
إقرأ أيضاً… مقدمة في فيزياء الذرة.
كيفية تحديد الصيغة التجريبية.
- ابدأ بعدد الجرامات لكل عنصر، والذي عادة ما تجده في التجربة أو قدمته في مسألة ما.
- لتسهيل الحساب، افترض أن الكتلة الإجمالية للعينة هي 100 جرام، لذا يمكنك العمل بنسب مئوية بسيطة. بمعنى آخر، اضبط كتلة كل عنصر على النسبة المئوية. يجب أن يكون المجموع 100 بالمائة.
- استخدم الكتلة المولية التي تحصل عليها عن طريق جمع الوزن الذري للعناصر من الجدول الدوري لتحويل كتلة كل عنصر إلى مولات.
- اقسم كل قيمة مول على عدد المولات الصغير الذي حصلت عليه من الحساب.
- قرب كل رقم تحصل على أقرب عدد صحيح. الأعداد الصحيحة هي النسبة المولية للعناصر في المركب، وهي الأرقام السفلية التي تتبع رمز العنصر في الصيغة الكيميائية.
أحيانًا يكون تحديد نسبة العدد الصحيح أمرًا صعبًا وستحتاج إلى استخدام التجربة والخطأ للحصول على القيمة الصحيحة. للقيم القريبة من x.5، ستضرب كل قيمة في نفس العامل للحصول على أصغر عدد صحيح مضاعف.
على سبيل المثال، إذا حصلت على 1.5 لحل ما، فاضرب كل رقم في المسألة في 2 لتصبح 1.5 هي 3. إذا حصلت على القيمة 1.25، اضرب كل قيمة في 4 لتحويل 1.25 إلى 5.
استخدام الصيغة التجريبية لإيجاد الصيغة الجزيئية.
يمكنك استخدام الصيغة التجريبية لإيجاد الصيغة الجزيئية إذا كنت تعرف الكتلة المولية للمركب.
للقيام بذلك، احسب كتلة الصيغة التجريبية ثم اقسم الكتلة المولية المركبة على كتلة الصيغة التجريبية. يمنحك هذا النسبة بين الصيغتين الجزيئية والتجريبية.
اضرب جميع الرموز الموجودة في الصيغة التجريبية بهذه النسبة للحصول على الرموز الفرعية للصيغة الجزيئية.
إقرأ أيضاً… عنصر الكربون (C): الخصائص والحقائق.
حساب مثال الصيغة التجريبية.
تم تحليل المركب وحسابه بحيث يتكون من 13.5 جم Ca، و 10.8 جم O، و 0.675 جم H. أوجد الصيغة التجريبية للمركب.
- ابدأ بتحويل كتلة كل عنصر إلى مولات من خلال البحث عن الأعداد الذرية من الجدول الدوري. الكتل الذرية للعناصر هي 40.1 جم / مول لـ Ca ، و 16.0 جم / مول لـ O ، و 1.01 جم / مول لـ H.
13.5 جم Ca x (1 مول Ca / 40.1 جم Ca) = 0.337 مول Ca
10.8 جم O x (1 مول O / 16.0 جم O) = 0.675 مول O
0.675 جم H × (1 مول H / 1.01 جم H) = 0.668 مول H
- بعد ذلك، اقسم كل كمية مول على أصغر عدد أو مولات (وهو 0.337 للكالسيوم) وقم بالتقريب إلى أقرب عدد صحيح:
0.337 مول Ca / 0.337 = 1.00 مول Ca
0.675 مول O / 0.337 = 2.00 مول O
0.668 مول H / 0.337 = 1.98 جزيء جرامي H والتي تقرب إلى 2.00
- الآن لديك رموز الذرات في الصيغة التجريبية: CaO2H2
- أخيرًا، قم بتطبيق قواعد كتابة الصيغ لتقديم الصيغة بشكل صحيح. يتم كتابة الكاتيون للمركب أولاً، متبوعًا بالأنيون. تمت كتابة الصيغة التجريبية بشكل صحيح كـ Ca (OH) 2