يكون جزيء الماء قطبي، ويعمل أيضًا كمذيب قطبي. عندما يقال إن نوعًا كيميائيًا “قطبي”، فهذا يعني أن الشحنات الكهربائية الموجبة والسالبة موزعة بشكل غير متساو.
تأتي الشحنة الموجبة من نواة الذرة، بينما تزود الإلكترونات بالشحنة السالبة. إنها حركة الإلكترونات التي تحدد القطبية. إليك كيف تعمل قطبية الماء.
لماذا جزيء الماء قطبي؟
جزيء الماء قطبي لأنه يحتوي على هندسة منحنية تضع ذرات الهيدروجين موجبة الشحنة على جانب واحد من الجزيء وذرة الأكسجين سالبة الشحنة على الجانب الآخر من الجزيء.
التأثير الصافي هو ثنائي القطب الجزئي، حيث تحتوي الهيدروجين على شحنة موجبة جزئية وذرة الأكسجين لها شحنة سالبة جزئية.
السبب في انحناء جزيء الماء هو أن ذرة الأكسجين لا تزال تحتوي على زوجين منفردين من الإلكترونات بعد أن ترتبط بالهيدروجين. تتنافر هذه الإلكترونات مع بعضها البعض، مما يؤدي إلى ثني رابطة O-H بعيدًا عن الزاوية الخطية.
قطبية جزيء الماء.
الماء (H2O) قطبي بسبب الشكل المنحني للجزيء.
يعني الشكل معظم الشحنة السالبة من الأكسجين على جانب الجزيء والشحنة الموجبة لذرات الهيدروجين على الجانب الآخر من الجزيء. هذا مثال على الترابط الكيميائي التساهمي القطبي.
عند إضافة المواد المذابة إلى الماء، قد تتأثر بتوزيع الشحنة. السبب في أن شكل الجزيء ليس خطيًا وغير قطبي (على سبيل المثال، مثل CO2) هو بسبب الاختلاف في الكهربية بين الهيدروجين والأكسجين.
تبلغ قيمة الكهربية للهيدروجين 2.1، بينما تبلغ كهرسلبية الأكسجين 3.5. كلما قل الاختلاف بين قيم الكهربية، زاد احتمال تكوين الذرات رابطة تساهمية. يُلاحظ اختلاف كبير بين قيم الكهربية في الروابط الأيونية.
يعمل كل من الهيدروجين والأكسجين كالمواد اللافلزية في الظروف العادية، لكن الأكسجين أكثر كهرسلبية من الهيدروجين، لذلك تشكل الذرتان رابطة كيميائية تساهمية، لكنها قطبية.
تجذب ذرة الأكسجين عالية الكهرسلبية الإلكترونات أو الشحنة السالبة إليها، مما يجعل المنطقة المحيطة بالأكسجين أكثر سلبية من المناطق المحيطة بذرتين الهيدروجين.
تنثني الأجزاء الموجبة كهربائيًا للجزيء (ذرات الهيدروجين) بعيدًا عن مداري الأكسجين المملوءين.
بشكل أساسي، تنجذب ذرتا الهيدروجين إلى نفس الجانب من ذرة الأكسجين، لكنهما بعيدتان عن بعضهما البعض بقدر الإمكان لأن ذرات الهيدروجين تحمل شحنة موجبة. التشكل المنحني هو توازن بين الجذب والتنافر.
تذكر أنه على الرغم من أن الرابطة التساهمية بين كل من الهيدروجين والأكسجين في الماء قطبية، فإن جزيء الماء هو جزيء متعادل كهربائيًا بشكل عام.
يحتوي كل جزيء ماء على 10 بروتونات و 10 إلكترونات بشحنة صافية قدرها 0.
إقرأ أيضاً… مقدمة في فيزياء الذرة.
لماذا الماء مذيب قطبي؟
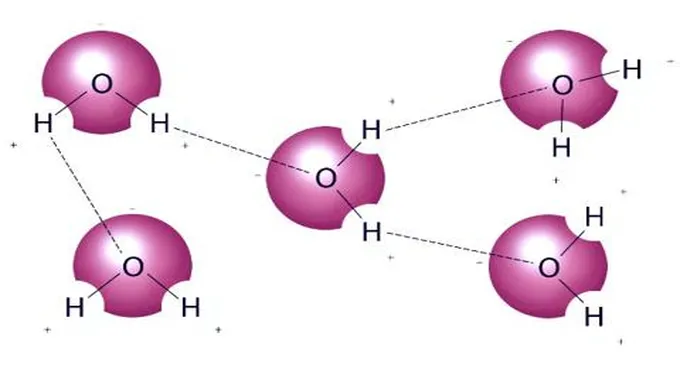
يؤثر شكل كل جزيء ماء على طريقة تفاعله مع جزيئات الماء الأخرى ومع المواد الأخرى. يعمل الماء كمذيب قطبي لأنه يمكن أن ينجذب إلى الشحنة الكهربائية الموجبة أو السالبة على مادة مذابة.
تجذب الشحنة السالبة الطفيفة بالقرب من ذرة الأكسجين ذرات الهيدروجين القريبة من الماء أو المناطق الموجبة الشحنة من الجزيئات الأخرى.
يجذب جانب الهيدروجين الموجب قليلاً لكل جزيء ماء ذرات أكسجين أخرى ومناطق سالبة الشحنة من الجزيئات الأخرى.
إن الرابطة الهيدروجينية بين الهيدروجين لجزيء ماء والأكسجين من جزيء آخر تحافظ على تماسك الماء وتعطيها خصائص مثيرة للاهتمام، ومع ذلك فإن الروابط الهيدروجينية ليست قوية مثل الروابط التساهمية.
بينما تنجذب جزيئات الماء إلى بعضها البعض عبر الروابط الهيدروجينية، فإن حوالي 20٪ منها تكون حرة في أي وقت للتفاعل مع الأنواع الكيميائية الأخرى. هذا التفاعل يسمى الترطيب أو الذوبان.