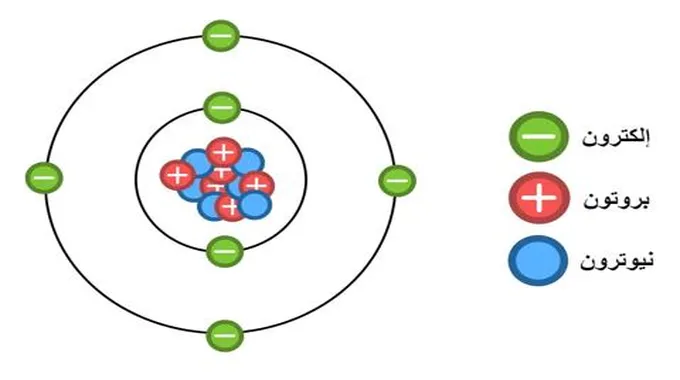
تتكون الذرة من ثلاثة جسيمات وهي البروتونات والنيوترونات، التي تشكل نواة الذرة، والإلكترونات التي تدور حول النواة، لكن ما هو الإلكترون؟
ما هو الإلكترون؟
الإلكترون هو جسيم دون ذري سالب الشحنة يمكن أن يرتبط بذرة أو أن يكون حراً (غير مرتبط). الإلكترون المرتبط بالذرة هو أحد الأنواع الثلاثة الأساسية للجسيمات داخل الذرة – النوعان الآخران هما البروتونات والنيوترونات.
تشكل الإلكترونات والبروتونات والنيوترونات معًا نواة الذرة. يحتوي البروتون على شحنة موجبة تقاوم شحنة الإلكترون السالبة. عندما تحتوي الذرة على نفس عدد البروتونات والإلكترونات، فإنها تكون في حالة محايدة.
الإلكترونات فريدة من نوعها من الجسيمات الأخرى بطرق متعددة. توجد خارج النواة، وهي أصغر بكثير في الكتلة وتظهر خصائص تشبه الموجة والجسيمات.
يعد الإلكترون أيضًا جسيمًا أوليًا، مما يعني أنه لا يتكون من مكونات أصغر. يُعتقد أن البروتونات والنيوترونات مكونة من كواركات، لذا فهي ليست جسيمات أولية.
إقرأ أيضاً… مقدمة في فيزياء الذرة.
الغلاف والغلاف الفرعي والمدارات.
في الأيام الأولى للدراسة الذرية، اعتقد العلماء أن إلكترونات الذرة تدور حول النواة في مدارات كروية على مسافات محددة، تمامًا مثل الكواكب التي تدور حول الشمس.
في هذا النموذج – المشار إليه بنموذج بور – تحتوي المدارات الأبعد عن النواة على أكبر قدر من الطاقة. عندما يقفز إلكترون من مدار طاقة أعلى إلى مدار طاقة أقل، تطلق الذرة إشعاعًا كهرومغناطيسيًا.
لم يعد يُعتقد أن نموذج بوهر دقيق، خاصة أنه يتعلق بكيفية دوران الإلكترونات حول النواة.
في حين أن النموذج لا يزال مفيدًا في فهم أساسيات توزيع الإلكترون ومستويات الطاقة المختلفة، فإنه يفشل في النظر في تعقيد هذا التوزيع وكيف تسكن الإلكترونات في الفضاء حول النواة، وفقًا لنظرية الكم الحالية.
يتم تحديد حركة الإلكترون من خلال حساب احتمال العثور على إلكترونات في مناطق معينة داخل الفضاء الذي يحيط بنواة الذرة، بدلاً من افتراض مسارات ثابتة. تعتمد المناطق المحددة رياضيًا على ثلاثة أنماط هيكلية:
1. الغلاف.
نشأ مفهوم الغلاف مع نموذج بور، على الرغم من تطور النظرية حول الغلاف. يعتقد الفيزيائيون الآن أن الغلاف هي منطقة احتمالية تحيط بالنواة.
يمكن أن تحتوي الذرة على ما يصل إلى سبع أغلفة للإلكترونات، اعتمادًا على نوع الذرة. توجد الأغلفة على مستويات مختلفة حول النواة. تحتوي الأغلفة الأبعد عن النواة على أعلى كميات من الطاقة وتلك الأقرب هي الأقل.
يقتصر كل غلاف على عدد محدد من الإلكترونات، اعتمادًا على مستواها وتكوينها. يمكن أن يحتوي الغلاف على غلاف فرعي واحد أو أكثر، ويمكن أن يحتوي الغلاف الفرعي على واحد أو أكثر من المدارات.
2. الغلاف الفرعي.
الغلاف الفرعي هو مجموعة من واحد أو أكثر من المدارات من نوع معين. هناك أربعة أنواع من المدارات، وبعد ذلك أربعة أنواع من الأغلفة الفرعية – تم تحديدها على أنها s و p و d و f، اعتمادًا على مداراتها.
يحتوي الغلاف الفرعي s على مدار واحد s ، ويحتوي الغلاف الفرعي p على ثلاثة مدارات p، ويحتوي الغلاف الفرعي d على خمسة مدارات d، ويحتوي الغلاف الفرعي f على سبعة مدارات f.
تم الافتراض أيضًا أن الذرة يمكن أن تدعم غلافاً فرعياً يسمى g ويحتوي على تسعة مدارات g.
3. المدارات.
المدار هو منطقة ذات شكل خاص من الفضاء حول النواة حيث يوجد إلكترون على الأرجح. بمعنى آخر، إنها المنطقة ذات الاحتمالية الأعلى (أكثر من 90٪) لاحتواء الإلكترون أثناء انتقاله حول النواة.
قد يكون المدار على شكل كرة (مداري)، أو دمبل (مداري p) أو شكل أكثر تعقيدًا (مداري d و f). مهما كان شكله، يمكن أن يشتمل المدار على إلكترونين كحد أقصى.
إقرأ أيضاً… ما هي مكونات الذرة؟
تسميات الأغلفة المحيطة بالذرة.
يتم ترقيم أغلفة الذرة على التوالي، بدءًا من النواة وحتى الخارج. غالبًا ما يُشار إلى رقم الغلاف على أنه قيمته n. على سبيل المثال، قد يشار إلى الغلاف الثالث على أنه n = 3 أو 3n.
تستخدم الأحرف أحيانًا للإشارة إلى الأغلفة. وتشمل هذه K و L و M و N و O و P و Q، مرة أخرى بدءًا من النواة وحتى الخارج. على سبيل المثال، قد يشار إلى الغلاف الثالث باسم M shell أو 3m.
يحتوي كل غلاف على نوع واحد أو أكثر من الأنواع الفرعية المحددة، والتي تحدد الحد الأقصى لعدد الإلكترونات التي يمكن أن يحتويها الغلاف.
على سبيل المثال، يحتوي الغلاف الأول (K) على غلاف فرعي واحد يحتوي على مدار s واحد فقط. ونتيجة لذلك، فإن الحد الأقصى لعدد الإلكترونات التي يمكن أن يحتويها الغلاف هو اثنان.
هذا يعني أن الذرة التي تحتوي على غلاف K فقط تقتصر على إلكترونين. عنصران فقط، الهيدروجين والهيليوم، لهما غلاف واحد.
يحتوي الهيدروجين على إلكترون واحد فقط ويحتوي الهليوم على إلكترونين. يختلف التكوين الفرعي / المداري من غلاف إلى آخر، ويزداد تعقيدًا حتى الغلاف الخامس، وعند هذه النقطة يبدأ التعقيد في التناقص التدريجي.
على سبيل المثال، الغلاف الثاني (L) يتضمن s subshell و p subshell. يحتوي الغلاف الفرعي s على مدار واحد s، بينما يحتوي الغلاف الفرعي p على ثلاثة مدارات p. هذا يعني أن الغلاف يمكنه دعم ما يصل إلى ثمانية إلكترونات.
الغلاف والغلاف الفرعي.
ومع ذلك، تحتوي الذرة ذات الغلاف L أيضًا على غلاف K. في الواقع، سيبدأ غلاف L بالملء بعد ملء غلاف K. هذا يعني أن الذرة ذات الغلاف L يمكنها أن تدعم ما يصل إلى 10 إلكترونات بسبب وجود كل من الغلافين K و L.
على سبيل المثال، يحتوي الليثيوم والنيون على أغلفة K و L. تحتوي ذرة الليثيوم على ثلاثة إلكترونات فقط، اثنان في الغلاف K وواحد في الغلاف L، ولكن تحتوي ذرة النيون على 10 إلكترونات، واثنان في الغلاف K وثمانية في الغلاف L.
بشكل عام، يستمر هذا النمط نفسه لجميع الأغلفة السبعة، حيث تمتلئ الأغلفة الداخلية بالإلكترونات قبل الأغلفة الخارجية. ومع ذلك، هذا مجرد اتجاه.
تنجذب الإلكترونات نحو التكوين الأكثر استقرارًا، وهو عادةً الغلاف الداخلي، ولكن من الممكن أيضًا أن تبدأ الغلاف الخارجي بالملء بالإلكترونات قبل أن يمتلئ الغلاف السفلي تمامًا.
بغض النظر عن الترتيب الذي تُملأ به الأغلفة بالإلكترونات، تحدد الأغلفة نفسها الحد الأقصى لعدد الإلكترونات التي يمكنها دعمها بناءً على الأغلفة الفرعية والمدارات.
تحتوي جميع الأغلفة باستثناء الغلاف الأول على غلاف فرعي p، ويحتوي الغلاف الثالث إلى السادس فقط على غلاف فرعي d، بينما يحتوي الغلاف الرابع والخامس فقط على أغلفة فرعية f. تشتمل جميع الأغلفة السبع على أغلفة فرعية.
إقرأ أيضاً… ما هو مصادم الهدرونات الكبير؟
الإلكترونات والكهرباء.
في الموصلات الكهربائية، يتدفق التيار الكهربائي نتيجة قفز الإلكترونات من ذرة إلى ذرة أثناء انتقالها من أقطاب كهربائية سالبة إلى أقطاب كهربائية موجبة.
في مواد أشباه الموصلات، ينتج التيار أيضًا عن حركة الإلكترون، ومع ذلك، فإن الحركة تعتمد على نقص الإلكترون في الذرات. تسمى الذرة التي تعاني من نقص الإلكترون في أشباه الموصلات بالثقب.
في هذه الحالة، ينتقل التيار من أقطاب كهربائية موجبة إلى سالبة. يشار إلى شحنة إلكترون واحد باسم شحنة الوحدة الكهربائية. وهي تحمل شحنة سالبة تساوي الشحنة الموجبة على البروتون أو الثقب ولكنها معاكسة لها.
ومع ذلك، لا يتم قياس كمية الشحنة الكهربائية عادةً على إلكترون واحد لأن هذه الكمية صغيرة جدًا. بدلاً من ذلك، فإن الوحدة القياسية للشحنة الكهربائية هي الكولوم (التي يرمز إليها ب C).
يحتوي الكولوم على حوالي 6.24 × 10^18 إلكترونًا. تبلغ شحنة الإلكترون (التي يرمز إليها بالرمز e) حوالي 1.60 × 10^-19 كولوم.
وتبلغ كتلة الإلكترون في حالة السكون (التي يرمز إليها me) حوالي 9.11 × 10-31 كجم (kg). إذا تم تسريع الإلكترونات إلى ما يقرب من سرعة الضوء، كما هو الحال في مسارع الجسيمات، فسيكون لها كتلة أكبر بسبب التأثيرات النسبية.