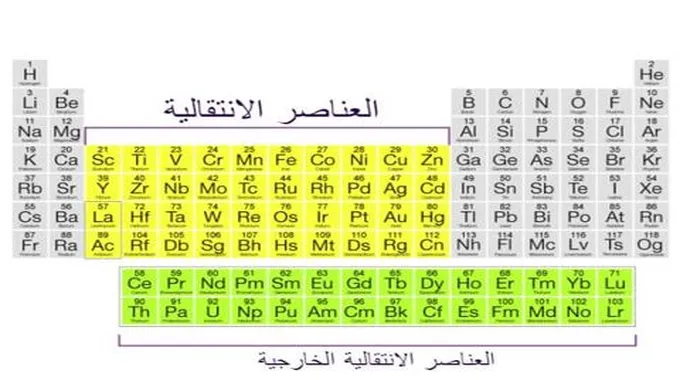
أكبر مجموعة من العناصر في الجدول الدوري هي المعادن الانتقالية، والتي توجد في منتصف الجدول الدوري.
أيضًا، صفان من العناصر أسفل الجسم الرئيسي للجدول الدوري (اللانثانيدات والأكتينيدات) هما مجموعات فرعية خاصة من هذه المعادن.
تسمى هذه العناصر “معادن انتقالية” لأن إلكترونات ذراتها تقوم بالانتقال لملء المستوى الفرعي d أو المدار الفرعي d. وبالتالي، تُعرف المعادن الانتقالية أيضًا باسم عناصر d-block.
فيما يلي قائمة بالعناصر التي تعتبر معادن انتقالية أو عناصر انتقالية. لا تشمل هذه القائمة اللانثانيدات أو الأكتينيدات، فقط العناصر الموجودة في الجزء الرئيسي من الجدول الدوري.
قائمة العناصر الانتقالية في الجدول الدوري.
- السكانديوم – Scandium
- التيتانيوم – Titanium
- الفاناديوم – Vanadium
- الكروم – Chromium
- المنغنيز – Manganese
- الحديد – Iron
- الكوبالت – Cobalt
- النيكل – Nickel
- النحاس – Copper
- الزنك – Zinc
- الإيتريوم – Yttrium
- الزركونيوم – Zirconium
- النيوبيوم – Niobium
- الموليبدينوم – Molybdenum
- التكنيتيوم – Technetium
- الروثينيوم – Ruthenium
- الروديوم – Rhodium
- البلاديوم – Palladium
- الفضة – Silver
- الكادميوم – Cadmium
- اللانثانم – Lanthanum
- الهافنيوم Hafnium
- التنتالوم – Tantalum
- التنغستن – Tungsten
- الرينيوم – Rhenium
- الأوزميوم – Osmium
- الإيريديوم – Iridium
- البلاتين – Platinum
- الذهب – Gold
- الزئبق – Mercury
- الأكتينيوم – Actinium
- الرذرفورديوم – Rutherfordium
- الدوبنيوم – Dubnium
- السيبورجيوم – Seaborgium
- البوهريوم – Bohrium
- الهاسيوم – Hassium
- المينيريوم – Meitnerium
- الدارمشتاتيوم – Darmstadtium
- الرونتجينيوم – Roentgenium
- الكوبرنسيوم – Copernicium
إقرأ أيضاً… ما هو الفرق بين المولارية والمولالية في الكيمياء؟
خصائص المعادن الانتقالية.
المعادن الانتقالية هي العناصر التي تفكر بها عادة عندما تتخيل معدنًا. تشترك هذه العناصر في الخصائص مع بعضها البعض:
- موصلات ممتازة للحرارة والكهرباء.
- المعادن الانتقالية قابلة للطرق (من السهل تشكيلها أو ثنيها).
- تميل هذه المعادن إلى أن تكون شديدة الصلابة.
- تبدو المعادن الانتقالية لامعة ومعدنية. معظم المعادن الانتقالية رمادية أو بيضاء (مثل الحديد أو الفضة)، لكن الذهب والنحاس لهما ألوان لم تظهر في أي عنصر آخر في الجدول الدوري.
- المعادن الانتقالية، كمجموعة، لها نقاط انصهار عالية. الاستثناء هو الزئبق، وهو سائل عند درجة حرارة الغرفة. بالتبعية، تحتوي هذه العناصر أيضًا على نقاط غليان عالية.
- تصبح مداراتهم d مملوءة تدريجياً وأنت تتحرك من اليسار إلى اليمين عبر الجدول الدوري. نظرًا لعدم ملء الطبقة السفلية، فإن ذرات المعادن الانتقالية لها حالات أكسدة موجبة وتعرض أيضًا أكثر من حالة أكسدة واحدة. على سبيل المثال، عادةً ما يحمل الحديد حالة أكسدة 3+ أو 2+. قد يكون للنحاس حالة أكسدة 1+ أو 2+. تعني حالة الأكسدة الإيجابية أن المعادن الانتقالية تشكل عادة مركبات أيونية أو أيونية جزئيًا.
- ذرات هذه العناصر لها طاقات تأين منخفضة.
- تشكل المعادن الانتقالية معقدات ملونة، لذلك قد تكون مركباتها وحلولها ملونة. تقسم المجمعات المدار d إلى مستويين فرعيين للطاقة بحيث تمتص أطوال موجية محددة من الضوء. بسبب حالات الأكسدة المختلفة، من الممكن أن ينتج عنصر واحد معقدات وحلول في نطاق واسع من الألوان.
- على الرغم من أن الفلزات الانتقالية تفاعلية، إلا أنها ليست تفاعلية مثل العناصر التي تنتمي إلى مجموعة الفلزات القلوية.
- تشكل العديد من المعادن الانتقالية مركبات شبه مغناطيسية.