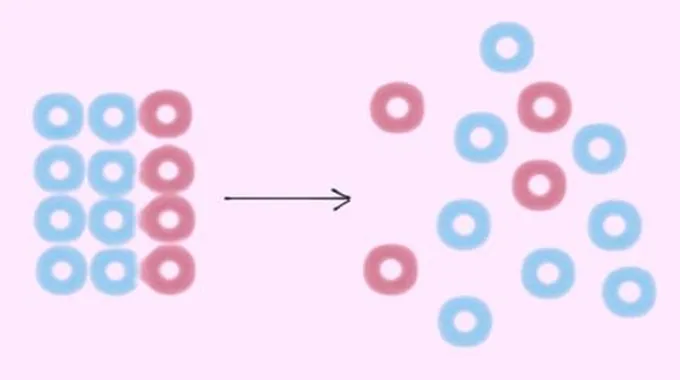
يتم تعريف العشوائية أو الانتروبيا (Entropy) بأنه المقياس الكمي للاضطراب أو العشوائية في النظام. يأتي هذا المفهوم من الديناميكا الحرارية، التي تتعامل مع نقل الطاقة الحرارية داخل النظام.
بدلاً من الحديث عن شكل من أشكال “الانتروبيا المطلقة”، يناقش الفيزيائيون عمومًا التغيير في الانتروبيا الذي يحدث في عملية ديناميكية حرارية معينة.
كيفية حساب الانتروبيا.
في عملية متساوية الحرارة، التغيير في الانتروبيا (delta-S) هو التغير في الحرارة (Q) مقسومًا على درجة الحرارة المطلقة (T):
delta-S = Q/T
في أي عملية ديناميكية حرارية عكسية، يمكن تمثيلها في حساب التفاضل والتكامل على أنها جزء لا يتجزأ من الحالة الأولية للعملية إلى حالتها النهائية dQ / T.
بمعنى أكثر عمومية، الإنتروبيا هي مقياس للاحتمال والاضطراب الجزيئي للنظام العياني. في نظام يمكن وصفه بالمتغيرات، قد تفترض هذه المتغيرات عددًا معينًا من التكوينات.
إذا كان كل تكوين محتمل بالتساوي، فإن الانتروبيا هي اللوغاريتم الطبيعي لعدد التكوينات، مضروبة في ثابت بولتزمان:
S = kB ln W
حيث S عبارة عن إنتروبيا، و kB هو ثابت بولتزمان، و ln هو اللوغاريتم الطبيعي، ويمثل W عدد الحالات الممكنة. ثابت بولتزمان يساوي 1.38065 × 10^−23 J / K.
وحدات قياس الانتروبيا.
تعتبر العشوائية خاصية واسعة النطاق للمادة التي يتم التعبير عنها من حيث الطاقة مقسومة على درجة الحرارة. وحدات قياسها في النظام الدولي للوحدات هي J / K (جول / درجات كلفن).
الانتروبيا والقانون الثاني للديناميكا الحرارية.
إحدى الطرق لتوضيح القانون الثاني للديناميكا الحرارية هي كما يلي: في أي نظام مغلق، ستبقى إنتروبيا النظام إما ثابتة أو تزداد.
يمكنك عرض هذا على النحو التالي: تؤدي إضافة الحرارة إلى نظام ما إلى تسريع الجزيئات والذرات. قد يكون من الممكن (على الرغم من صعوبة ذلك) عكس العملية في نظام مغلق دون سحب أي طاقة من أو إطلاق طاقة في مكان آخر للوصول إلى الحالة الأولية.
لا يمكنك أبدًا جعل النظام بأكمله “أقل نشاطًا” مما كان عليه عندما بدأ. الطاقة ليس لديها أي مكان تذهب إليه. بالنسبة للعمليات التي لا رجعة فيها، فإن الانتروبيا المشتركة للنظام وبيئته تزداد دائمًا.
إقرأ أيضاً… ما هو الإلكترون في الذرة؟
المفاهيم الخاطئة حول الانتروبيا.
تحظى هذه النظرة للقانون الثاني للديناميكا الحرارية بشعبية كبيرة، وقد أسيء استخدامها. يجادل البعض بأن القانون الثاني للديناميكا الحرارية يعني أن النظام لا يمكن أبدًا أن يصبح أكثر تنظيماً. هذا غير صحيح.
هذا يعني فقط أنه لكي تصبح أكثر تنظيماً (لتقليل الإنتروبيا)، يجب عليك نقل الطاقة من مكان ما خارج النظام، مثل عندما تسحب المرأة الحامل الطاقة من الطعام لتتكون البويضة المخصبة في طفل.
وهذا يتوافق تمامًا مع أحكام القانون الثاني. تُعرف العشوائية أيضًا بالاضطراب والفوضى، على الرغم من عدم دقة المرادفات الثلاثة.
الانتروبيا المطلقة.
المصطلح ذو الصلة هو “الانتروبيا المطلقة”، والتي يتم الإشارة إليها بواسطة S بدلاً من ΔS. كما يتم تعريف الانتروبيا المطلقة وفقًا للقانون الثالث للديناميكا الحرارية. هنا يتم تطبيق ثابت يجعله يتم تعريف الإنتروبيا عند الصفر المطلق على أنه صفر.